Vähiravi ja diagnostika on viimase aastakümnega märkimisväärselt arenenud. Eriti geenitehnoloogia on avanud vähiravile uusi uksi ja sedamööda on paranenud ka prognoosid. Mõni uus ravim võib olla eriti tõhusa ravitoimega.
Hoolimata suurepärastest ravitulemustest on ravimite ja ravivõimaluste teekond laborist patsiendini pikk.
Kui laboris toimub mõni paljulubav avastus ja nähakse, et see võiks olla põnev uurimisobjekt ja molekulidki on teada, kulub ikka tavaliselt 10–15 aastat, enne kui lõpptulemuse – näiteks ravimid – võib kliinikusse rutiinseks kasutamiseks toimetada. Tänapäeval on püütud protsessi pisut kiirendada, kuid see on endiselt pikk teekond.
Õnneks viiakse pidevalt läbi uusi akadeemilisi uuringuid ja kliinilisi ravimikatseid. Sageli rahastavad vähiravimite kliinilisi uuringuid rahvusvahelised ravimifirmad, sh Roche, et välja selgitada uute ravimite mõju.
Diagnostika arendamine ja geneetilise teabe mõju vähiravile
Kasvajate uurimiseks on vaja mitmekesist diagnostikat. Viimase kümne aasta jooksul on eriti piltdiagnostika aga ka geenitestid tublisti edasi arenenud. Kui veel kümmekond aastat tagasi oli diagnostika fookuses vähihistoloogia, st mikroskoobi all avanev patoloogiline vaatepilt vähikoest, siis nüüd pakuvad mitmesugused, nii kitsamad kui ka laiemad geneetilised testid tohutult lisateavet.
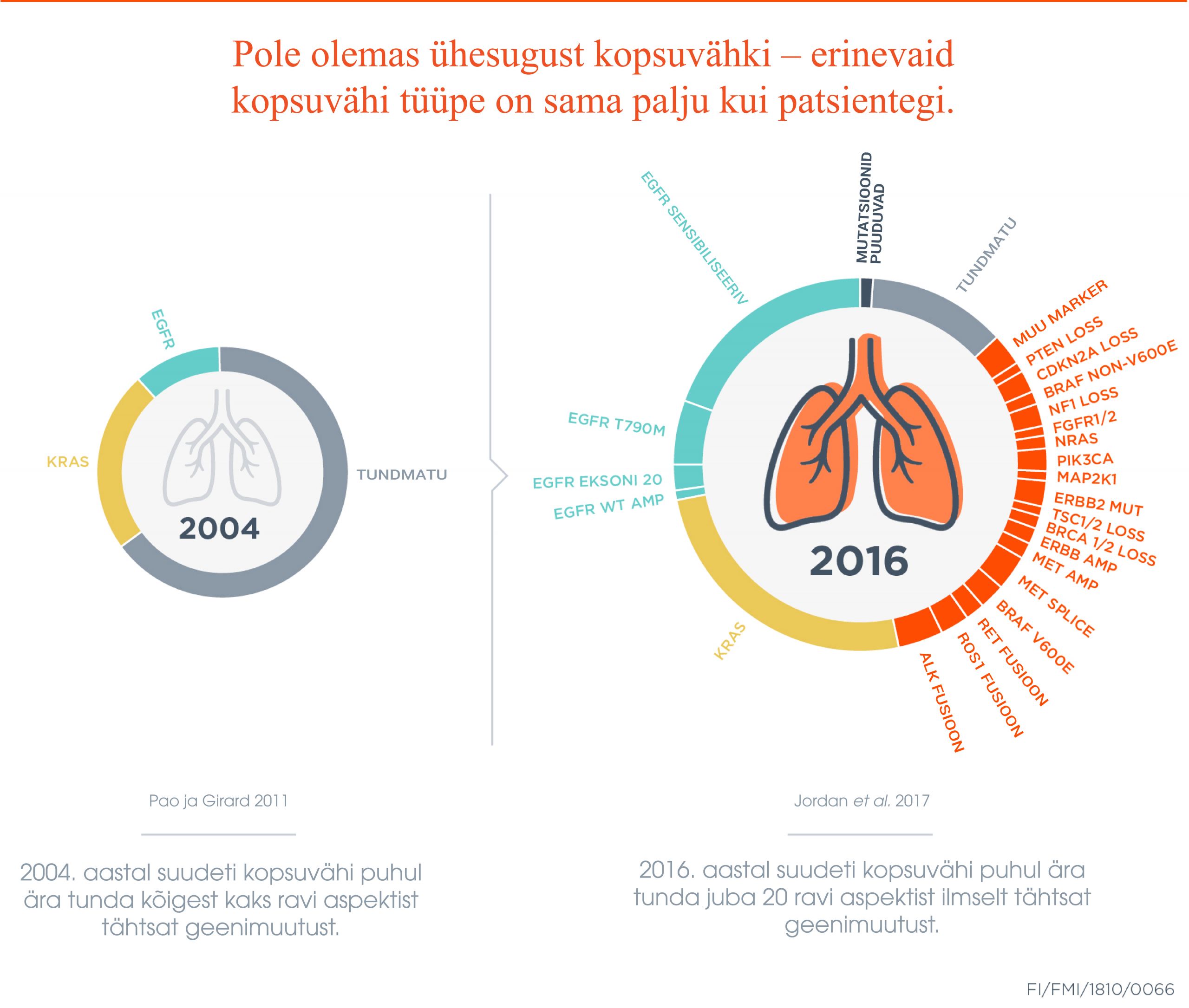
Tänapäeval põhineb patoloogiline diagnostika suuresti valkude analüüsimisel, st eri valkude immunohistokeemilisel värvimisel tuuakse nähtavale erinevate valkude olemasolu. Geenitestid, -paneelid ja teised sarnased diagnostikameetodid on andnud vähi kohta hulganisti lisateavet. Enam ei jaotata kasvajaid ainuüksi histoloogilisteks, st koelisteks alatüüpideks, vaid teada on, et kasvajad võivad olla sarnased mõne geneetilise mutatsiooni poolest. Näiteks günekoloogiline vähk võib olla sarnane oma geneetiliste muutuste osas mõne teise vähiga, kusjuures see teine vähk võib nt paikneda hoopis rindades või eesnäärmes. Küll aga võivad neil olla samad geneetilised tunnused, millest võib ravimisel kasu olla.
Geneetilise teabe laienedes saab endisest paremini tuvastada erinevaid kasvajate mutatsioone või patsiendi geenidefekte. See võimaldab ravi tõhusamalt suunata just sellest geenimuutusest tuleneva defekti osas. Teatud geenimutatsioonide kohta on juba praegu olemas tulemusi mõjutavaid ravivõimalusi.
Kui näiteks avastatakse patsiendil BRCA geeni mutatsioon, mida leitakse muu hulgas munasarja- ja rinnavähiga patsientidel, on see esimene usaldusväärne ennustav viide sellele, et konkreetne ravim osutub kõnealuse patsiendi puhul tõhusaks.
Geenitestide kasutamine haigete tervise parandamisel
Vähigenoomi teste, näiteks FoundationOne’i, kasutatakse vähidiagnostikas üha sagedamini. Testi kasutamise vajadust tuleb iga kord hoolega kaaluda, sest alati ja kõigi juhtude korral ei pruugi testi tulemusena teada saada uut infot geneetiliste muutuste osas ja sellest tulenevalt ei ole ka sihtmärki, mida oleks võimalik ravida. Samas, sellistel juhtudel aga võimaldab saadud info vältida tarbetut ravi ja säästa patsienti asjatutest kaasuvatest probleemidest.
Kõige sagedamini kaalutakse vähigenoomi testi kasutamist siis, kui patsiendi vähk on haruldane, selle raviks puudub n-ö standardravi või on tavapärased ravimeetodid juba end ammendanud.
Vähiraviskeemide ja -ravimite väljatöötamine
Mitmete erinevate vähkide osas on ravi viimase paari aasta jooksul märgatavalt arenenud. Suunatud ravimeetodid on muutunud ravivaliku osaks ja uus geenitehnoloogia on sillutanud teed endisest täpsematele ja tõhusamatele ravimitele. Paljutõotavaid tulemusi on nt saavutatud günekoloogiliste kasvajate osas erinevate immunoloogiliste ravimite ja PARP-inhibiitoritega, mis mõjutavad DNA parandusmehhanisme.
Täppisravi puhul püütakse ravimeetmeid sihtmärgistada senisest täpsemalt. Kui tavapärased keemia- ja kiiritusravi mõjutavad suures ulatuses paljusid rakufunktsioone, siis suunatud raviga püütakse mõjutada konkreetsest vähirakust leitud geenidefekti.
Kui on teada, et teatud geenis on teatud defekt ja konkreetse valgu funktsioon on kadunud või vigane, proovitakse konkreetse ravimi abil mõjutada otseselt leitud viga.
Uued tuuled vähiuuringutes
Jätkuvalt korraldatakse uusi ravimiuuringuid. Näiteks günekoloogiliste kasvajate valdkonnas on uusimad uuringusuunad DNA kahjustuste taastumise mehhanismid ja nende mõjutamine, samuti vähi resistentsusmehhanismide uurimine. DNA kahjustuste parandamise mehhanismid viitavad vähirakkude DNA eneseparandusele.
Ravimipõhises vähi- ja kiiritusravis on eesmärk kahjustada vähiraku DNAd nii, et seal käivituksid niisugused mehhanismid, mida vähirakk ei suuda enam parandada. Sel juhul sureb rakk DNA kahjustusse. Vähiraku surm on alati soovitud tulemus, kuid mõnikord juhtub, et vähirakk suudab talle tekitatud kahjustused parandada, mistõttu tekib antud ravimile resistentsus ehk vähirakk reageeri ei enam senisele ravile. On palju teisigi resistentsusmehhanisme, aga DNA kahjustuste parandamise taastekitamine on üks kesksetest mehhanismidest.
Vähi resistentsuse mehhanismide uurimisel püütakse leida viise, kuidas ületada ravimiresistentsust ja hoida vähiravi raviprotsessi vältel efektiivsena. Ravi alguses isegi väga hästi reageeriv kasvaja võib ravi ajal arendada välja resistentsuse, muutes seeläbi esialgu toimiva ravi ebaefektiivseks.
Vähiravis jõutakse paratamatult sellesse punkti, kus tsütostaatiline e. keemiaravi kaotab oma efektiivsuse ja ravivastust enam ei teki. See võib juhtuda isegi ravi algusetapis. Vähiravimite kasutuse eesmärk on muuta seda olukorda nii, et ravi oleks uuesti või siis aja möödudes taas efektiivne, et suudaksime ravimiresistentsuse mehhanismi tagasi pöörata.
Vähi võime muuta ennast ravimile mitte-reageerivaks mõjutab tugevasti sedagi, kui raskelt ravile alluvaks on vähk liigitatud.
Erinevaid vähitüüpe on seinast seina, seda isegi ühe organi piires. Vähiravi raskusaste sõltub kõnealuse vähkkasvaja resistentsustegurist. Resistentsustegur näitab, kas kasvaja on tundlik antud ravimeetodite suhtes või mitte. Seni on traditsioonilise kiiritus- või keemiaravile halvasti reageerivaid kasvajaid olnud keeruline ravida. Ent uued suunatud raviviisid võivad parandada ka selliste kasvajatega patsientide prognoosi.
Uued ravimeetodid pikendavad elu
Kaasaegsetel ravimeetoditel ja täienenud uurimisandmetel on positiivne mõju raviprognoosidele. Viimastel aastatel on aeg haiguse progresseerumiseni märkimisväärselt pikenenud. Tänapäeval võib mõnda vähitüüpi võrrelda näiteks raske diabeedi või astmaga – haigus vajab küll veel pidevat ravi, aga seda on võimalik kontrolli all hoida pikki aastaid.
Niinimetatud progresseerumise ajas, võrreldes haiguse mitteprogresseerumise ajaga, on täheldatud märkimisväärseid edasiminekuid, kuid üldise oodatava eluea osas mitte nii palju. Hiljutiste uuringute põhjal on näha, et on tulemas – ja on ka juba tulnud – ravimeid, mis võivad teatud patsiendirühmas anda eriti kauakestvaid ravivastuseid.
Uued ravimeetodid ja paremad ravimid teevad võimalikuks selle, et seni halva prognoosiga vähi diagnoosi saanud patsiendid võivad nüüd elada koguni aastakümneid ilma vähi progressioonita, nt on see nii melanoomi korral. Siiski ei osata veel kindlalt öelda, kas uued ravimid võiksid olla ka tervendavad.