Vähiravi on muutunud ja muutub aina täpsemaks ja personaalsemaks: personaalonkoloogia võimaldab lisaks ravitulemuste parandamisele, ka ravimite kõrvaltoimete riski vähendamist. Kaugemaleulatuvalt tähendab see ka meditsiinisüsteemi tõhustamist ja efektiivsemaks muutmist. Täppisonkoloogia üks osa on täppisdiagnostika, mis kasutab biomarkerite analüüsi õige ravi määramiseks õigel ajal õigele patsiendile.
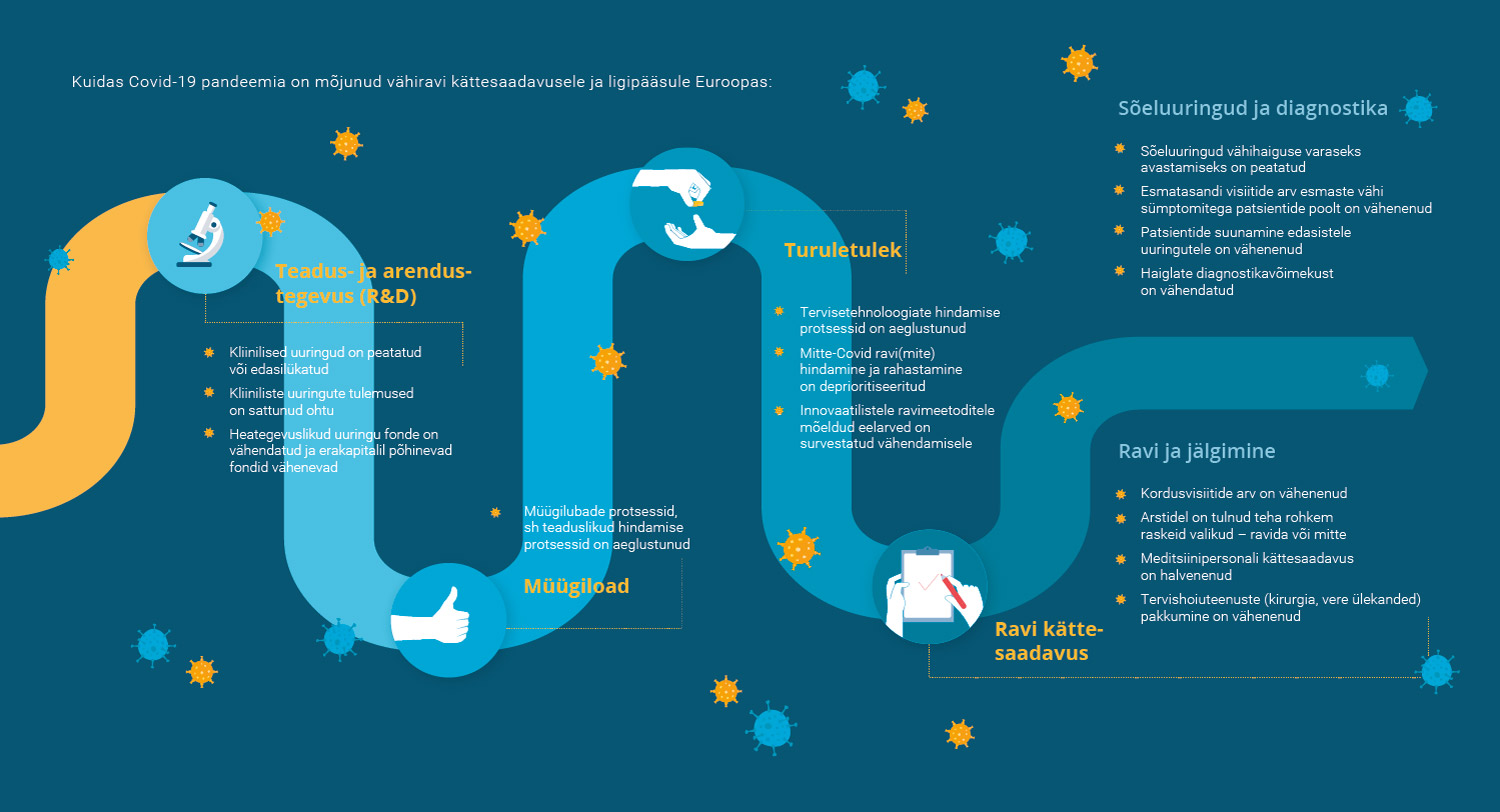
Isikustatud vähiravi uuendused võivad parandada ravitulemusi ja soodustada patsiendikesksust. Täppisravi kättesaadavus ja ligipääs on Euroopa patsientidele väga erinev ja selle ühtlustamiseks on seadusloome tasandil veel palju tegemata. näiteks 2016. aastast on teada isegi 5000 BRAF-muteerunud metastaatilise melanoomiga patsienti, kes ei saanud ravimit, mis oleks võinud nende elu päästa. Umbes 30% patsientidest Lääne-Euroopas, peaaegu 60% patsientidest Kesk-Euroopas ja umbes 90% patsientidest mõnes Ida-Euroopa riigis ei ole ligipääsu esmajärjekorras soovitatavale ravile. Samuti on riigiti erinev ravimite turule jõudmise kiirus.
Euroopa Ravimitootjate Föderatsioon (EFPIA) tellimusel analüüsis uuringukeskuse London School of Economics meditsiinitehnoloogia uurimisrühm tõenduspõhiselt isikustatud vähiravi kättesaadavust ning võimalikke takistusi Euroopas. Uuringutulemustel baseeruvalt (tutvu lähemalt siin) tehti ka ettepanekuid, kuidas isikustatud vähiravi Euroopas laialdasemalt kasutusele võtta ning kuidas luua võimalused Euroopa vähipatsientide tervise ja tulevikuväljavaadete parandamiseks.
Uuringust ilmnenud takistused isikustatud vähiravi kasutuselevõtus
Oluliste ja mõjuvate tõendite kogumine.
-
- Täppisravimite efektiivsuse tõendamine on raskendatud nii arenduse, müügiloa saamise, hinnakujunduse kui ka riikliku rahastuse saamise etapis.
- Täppisravimite uuringutega kaasnevad meditsiinilised, kliinilised, metodoloogilised ja eetilised probleemid.
- Reaaleluandmetel (real world evidence, RWE), milleks on näiteks patsiendi enda poolt teatatud ravitulemused, põhinevate või neid kasutavate kliiniliste uuringute arvestamine müügiloa andmisel ja riikliku rahastamise taotlemisel.
Aeglaselt muutuvad regulatsioonid
-
- Kehtivad õigusaktid mõjutavad täppisravimitele müügilubade andmist. Ametiasutuste peamiseks ülesandeks on protsesside muutmine, et ravimiuuendused kiiremini patsientideni jõuaks. Euroopa riikides on püütud seda probleemi lahendada ravimitele tingimuslike müügilubade andmise ja regulatiivsete protsesside kohandamisega.
- Vaja on ühtlustada Euroopa Liidu õigusakte täppisravimite ja nendega seotud diagnostiliste meetodite kohta ning lubada nn ristvalideerida erinevates kliinilistes uuringutes saadud biomarkerite tulemusi.
Rahastamismudelite jäikus ja riigiti suured erinevused
-
- Tervishoiutehnoloogia hindamine (HTA) ning ravimite hinnakujundus ja rahastamine on Euroopa piires erinevad, ravimite ja nendega seotud diagnostiliste testide rahastamine ei ole ühtlustatud. Praegused võimalused täppisdiagnostika ja täppisravi kasutamiseks praktikas on ebapiisavad. Ülevaatamist vajavad kriteeriumid, millega hinnatakse rahastamise vajalikkust ja võimalikkusthoogustada Euroopas täppisravimite kasutuselevõttu.
LOE KA
Kust leida usaldusväärset eestikeelset infot vähihaiguse kohta?
Kuidas vähigenoomi testi tehakse?
Mis on ja millal aitab vähigenoomi testimine?
Täppisravimid on eelkõige mõeldud patsientidele, kellele neist enim kasu on. Traditsiooniline meetod, mille puhul määratakse raviks n-ö “kõigile sobiv” ravim ei pruugi patsiendile alati parim valik olla. Kui aga võimalikult vara alustada kõige sobivama vähibiloogial põhineva raviga, on oodata paremaid ravitulemusi, paremat ravisoostumust, pikemat elumust ja väiksemat kõrvaltoimete riski. Täppisravimite kasutuselevõtt on kasulik ka sotsiaal-majanduslikust aspektist. On hinnatud, et varases staadiumis rinnavähiga patsientidel onl tööviljakuse kaod väiksemad kui neile teha enne keemiaravi vähi geneetiline testimine. Täppisravi saanud patsiendid kaotasid keskmiselt kolm kuni neli tööpäeva, samas kui keemiaravil olnud patsiendid kaotasid keskmiselt nädala.Kuigi algul tekib biomarkerite analüüsimise tõttu tervishoiusüsteemile lisakulutusi, võib isikustatud vähiravi lõppkokkuvõttes kujuneda soodsamaks kui traditsiooniline ravi. Prantsusmaal korraldatud uuringust selgus, et aastatel 2008–2014 säästeti tervishoius 459,6 miljonit eurot. Veidi üle 11 miljoni euro kulus EGFR-i biomarkerite analüüsiks, et teha rohkem kui 16 000 kopsuvähiga patsiendil kindlaks sobivaim ravim. On välja arvutatud, et üle maailma kulutatakse valediagnooside tõttu igal aastal pea 350 miljardit dollarit.
5 ettepanekut, et ühtlustada Euroopa patsientidele täppisravi(mite) kättesaadavus
- Luua Euroopa isikustatud vähiravi strateegia koos teekaardiga, mille põhimõtetele ja eesmärkidele toetudes oleks võimalik saavutada Euroopas suurem ühtsus ja tagada vajalikud vahendid.
- Eetikanõuete ühtlustamine Euroopa Liidu piires lubaks anonüümsete ja kaitstud patsiendiandmete jagamist üleeuroopalises võrgustikus.
- Isikustatud vähiraviga seotud ajakohaste teadmiste lisamine kõigi tervishoiutöötajate õppesse. Välja töötada mudel, kuidas jõuaks teave valdkonna uuendustest aktiivselt tegutsevate arstide kohustuslikku täiendõppesse. Patsientide liidud, huvikaitserühmad ja arstid peaksid püüdma suurendada patsientide teadlikkust tervishoiuteemadel, et julgustada neid avaldama soovi täppisravi kasutamiseks.
- Vähigeenide analüüs peaks olema kõigile sobivatele patsientidele kättesaadav ja ligipääsetav tavaravi osa nii diagnoosimise etapis kui ka haiguse arengu käigus.
- Tervishoiutehnoloogiaid (ravimite ja täppisdiagnostiliste testide majanduslikke analüüse) läbi viivad asutused peaksid heaks kiitma uuemad kliiniliste uuringute meetodid. Samuti tuleks EUnetHTA mudelile lisada isikustatud vähiravis tõendusmaterjali loomisele keskenduvad uued meetodid.